 Il metodo Pantellini nella lotta al “problema cancro” di Guido Paoli
Il metodo Pantellini nella lotta al “problema cancro” di Guido Paoli
La storia dell’ascorbato di potassio (sale derivato dalla vitamina C, totalmente atossico e privo di effetti collaterali almeno alle dosi consigliate di utilizzo) nasce “casualmente” (come spesso succede nelle scoperte scientifiche) nel 1948, quando un orafo amico del chimico fiorentino Gianfrancesco Valsé Pantellini, malato di tumore inoperabile allo stomaco ottenne dei benefici inattesi e straordinari bevendo delle limonate alle quali per errore aggiungeva bicarbonato di potassio al posto del comune bicarbonato di sodio.
Pantellini rimase sorpreso e sbalordito di un fatto che non riusciva a spiegarsi e, da uomo di scienza curioso ed attento ai particolari oltre che rigoroso nel metodo e nell’analisi, volle approfondire a fondo questo fatto per capire se si fosse trattato di un evento casuale, dovuto ad una serie di coincidenze fortunate ed irripetibili, oppure se ci fosse qualche m otivo “serio” per il quale un composto apparentemente così semplice potesse aver prodotto un risultato così impensabile.
Quindi separò i componenti principali dal succo di limone (rispettivamente, in ordine di concentrazione decrescente, acido citrico, acido tartarico ed acido ascorbico) e li salificò separatamente con il bicarbonato di potassio, ottenendo in tal modo sali di potassio (rispettivamente citrato, tartarato ed ascorbato di potassio) che fece assumere per 20 giorni, sempre separatamente, a quattro malati di tumore in fase avanzatissima, con il consenso e l’accordo dei loro medici curanti. Lo stesso Pantellini riferì che la somministrazione di citrato e tartarato di potassio non portarono alcun beneficio nei malati, mentre l’assunzione di ascorbato di potassio cambiò radicalmente non solo la loro qualità di vita ma soprattutto le conoscenze di Pantellini sulle cause dei tumori [biblio1-2].
Infatti il funzionamento della materia vivente viene prevalentemente indagato cercando di individuare la “molecola malata”, quel! lo che a lcuni chiamano il “determinismo segreto della malattia”, attraverso l’analisi sequenziale di interazione di singole molecole. Una visione completamente diversa emerge se guardiamo le proprietà collettive della materia. Infatti, i sistemi biologici non sono semplicemente “pezzi” di materia da assemblare ma sono sistemi aperti che possono scambiare informazioni con l’ambiente circostante sotto forma di energia e materia ed attraverso processi dinamici. Inoltre, tutti questi processi avvengono in soluzione acquosa che evidenzia forme di aggregazione straordinariamente sorprendenti, introducendo fenomeni di cooperatività e coerenza per orientare nel modo migliore il flusso di informazioni.
In questo senso, le patologie possono essere viste come difetti di comunicazione e l’analisi delle interazioni che avvengono soprattutto a distanza (alcuni diametri molecolari) coinvolge un livello di indagine di tipo fisico legato all’elettrodinamica quantistica, all’analisi dei sistemi din amici, allo studio delle strutture dissipative [3-6].
– La mutazione cellulare: danno diretto o indiretto sul DNA?
L’indagine del cancro segue la linea genetica, come danno indotto dall’accumulo di mutazioni in classi specifiche di geni del DNA (gli oncogeni). A causa di questo, le informazioni che dal DNA sono indirizzate alle “officine cellulari” (i mitocondri) per la costruzione di specifiche proteine od enzimi sono errate. Così le sostanze prodotte avranno un comportamento anomalo od addirittura potranno anche non essere utilizzate poiché incomplete.
L’orientamento che ha guidato finora questo indirizzo di ricerca è centrato sul cosiddetto Dogma Centrale della Biologia Molecolare, elaborato dal Premio Nobel Francis Crick e noto anche come l’assioma: “un gene, una proteina”, secondo il quale l’informazione si sviluppa seguendo un flusso unidirezionale, dal DNA verso i mitocondri per la sintesi delle proteine, senza interagire quindi con l’ambien te citoplasmatico.
Ma ci sono molte questioni aperte che mettono pesantemente in discussione questa visione a cominciare dal fatto che ci sono molte più proteine che geni codificanti, e continuando poi con i marcatori epigenetici, i geni che producono “solo” RNA, lo splicing alternativo, il controllo della complessità cellulare, i meccanismi di autoregolazione genetica. Molti “addetti ai lavori” iniziano a dire chiaramente (e concordo pienamente) che il dogma di Crick è concettualmente errato ed il DNA risulta soggetto ad uno scambio bi-direzionale delle informazioni con l’ambiente citoplasmatico.
In tal modo si capisce come, per una corretta comprensione dei meccanismi degenerativi, diventi decisivo dare una risposta alla domanda: la mutazione genetica che provoca la trasformazione della cellula in senso cancerogeno avviene per un danno diretto sul DNA, oppure è una conseguenza di processi che avvengono nella “periferia” della cellula (nel citoplasma) e che vengono “l etti” dal DNA come una spinta alla mutazione per “adeguarsi”! ad un a mbiente che sta cambiando? In sostanza, la mutazione genetica è la causa o l’effetto della degenerazione cellulare? La risposta a questa domanda potrebbe veramente aprire scenari completamente nuovi negli studi sul genoma come pure nella comprensione delle cause fisiologiche del cancro.
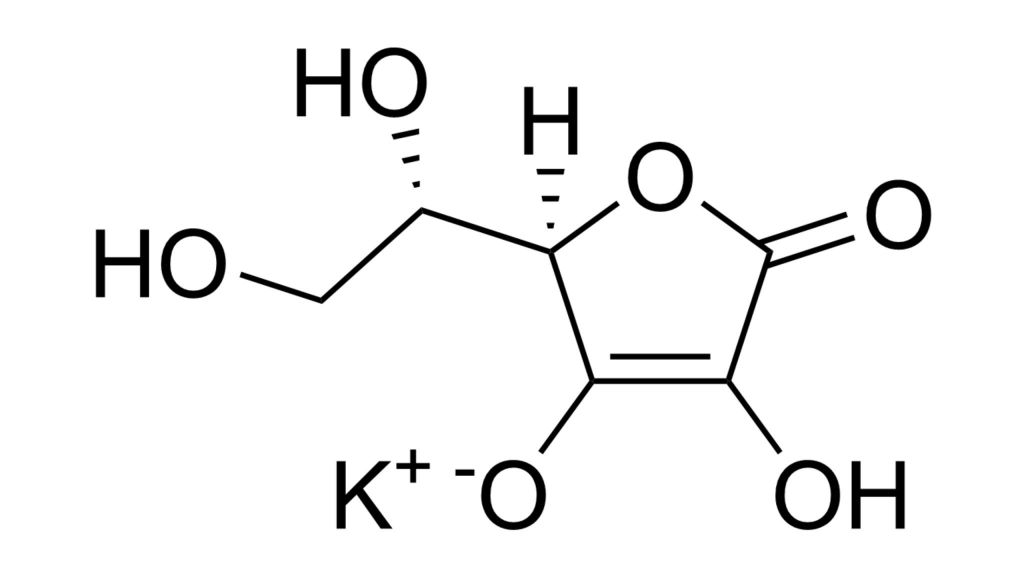
Ribosato e ascorbato di potassio
 È su questa base che si inseriscono gli studi e le ricerche sull’ascorbato di potassio, ora potenziato con il ribosio, portati avanti dalla Fondazione Pantellini [7-8] e dagli Enti Pubblici di ricerca con cui sono state attivate collaborazioni, in particolare il Dipartimento di Sanità Pubblica dell’Università di Parma (Prof.ssa Ortalli e Dott.ssa Croci) [9-11]. Questo composto sembra evidenziare importantissimi effetti sui meccanismi fisiologici che innescano il processo di cancerogenesi [12]. Infatti, l’impiego di ascorbato e ribosato di potassio, al di là dei risultati ottenuti in quasi sessant’anni di attività di ricerca, trovano la loro giustificazione profonda nell’ipotesi che i processi di degenerazione cellulare nascano da interruzioni nei processi di comunicazione provocati da squilibri locali che avvengono a livello della membrana cellulare.
È su questa base che si inseriscono gli studi e le ricerche sull’ascorbato di potassio, ora potenziato con il ribosio, portati avanti dalla Fondazione Pantellini [7-8] e dagli Enti Pubblici di ricerca con cui sono state attivate collaborazioni, in particolare il Dipartimento di Sanità Pubblica dell’Università di Parma (Prof.ssa Ortalli e Dott.ssa Croci) [9-11]. Questo composto sembra evidenziare importantissimi effetti sui meccanismi fisiologici che innescano il processo di cancerogenesi [12]. Infatti, l’impiego di ascorbato e ribosato di potassio, al di là dei risultati ottenuti in quasi sessant’anni di attività di ricerca, trovano la loro giustificazione profonda nell’ipotesi che i processi di degenerazione cellulare nascano da interruzioni nei processi di comunicazione provocati da squilibri locali che avvengono a livello della membrana cellulare.
L’azione d i queste molecole da una parte mantiene la corretta concentrazione di potassio nell’ambiente citoplasmatico delle cellule “sane”, attraverso l’azione di carrier dell’acido ascorbico e la funzione di catalizzatore del ribosio, che rende più rapido il trasferimento del catione nei comparti cellulari, mentre cercano di inibire i processi di duplicazione incontrollata. Nel caso del cancro, tali molecole sembrano in grado di limitare ed anche esaurire le risorse energetiche delle cellule neoplastiche in quanto favoriscono l’eliminazione del glucosio di cui le cellule tumorali sono ricche. È da notare che gli studi sul metabolismo del ribosio risalgono agli anni ’70 del secolo appena concluso [13] e che questo monosaccaride non è mai stato impiegato come tale in ambito sanitario. Il suo utilizzo rappresenta quindi una novità in campo internazionale.
Ruolo fisiologico del potassio e del sodio
Il potassio, in condizioni fisiologiche di base, è il principale catione intracellulare con una concentrazione media dell’ordine di 150 mMol/l ed è il regolatore critico per quanto riguarda il controllo del metabolismo cellulare, svolgendo la funzione di cofattore ed agendo come attivatore degli enzimi [14]. Permette inoltre una corretta attività delle proteine attraverso un particolare processo chiamato salificazione reversibile dei loro gruppi amminici (NH), anche di strutture cicliche come gli anelli pirrolici (presenti negli amminoacidi: istidina, prolina e triptofano), ed amminici (NH2) in ambiente leggermente acido. Nell’ambiente extracellulare la sua concentrazione oscilla fra 4 e 5 mMol/l. L’importanza del potassio è stata recentemente messa in evidenza in alcuni articoli sui meccanismi di apoptosi cellulare [15-17].
Il sodio, che svolge una f unzione importantissima per il bilancio idro-salino dell’organismo e per il trasporto del glucosio nelle cellule [18], ha un’elevata affinità chimica con il potassio mostrando concentrazioni inverse rispetto a questo: approssimativamente 150 mMol/l nell’ambiente extracellulare e circa 5 mMol/l nel citoplasma. Questo fatto si traduce in un importante gradiente di concentrazione dei due cationi fra l’interno e l’esterno della cellula, svolgendo un ruolo cruciale nei meccanismi di conduzione dei potenziali d’azione e di percezione sensoriale.
Stress ossidativi e processi degenerativi
I già citati studi del Dott. Pantellini e della Fondazione Valsé Pantellini, hanno permesso di ipotizzare che, in presenza di stress ossidativo, possa essere provocato un danno a livello della membrana cellulare ed in particolare della cosiddetta pompa sodio-potassio (che regola il trasporto attivo fra i due cationi), con conseguente squilibrio nelle concentrazioni dei due elettroliti che iniziano un processo di diffusione “semplice” dalle regioni con maggiore concentrazione a quelle con minore concentrazione, con il risultato di una perdita di potassio dal citoplasma ed una sua sostituzione con il sodio, fatto già evidenziato fin dal 1930 [19].
L’eccesso di sodio intracellulare, attraverso variazioni locali significative di pH, modifica i siti di legame per il potassio negli enzimi e nelle proteine, inducendo la distruzione del carattere aromatico deg li anelli pirrolici che vengono così aperti e svolgendo quindi un’azione biologica totalmente diversa. Abbiamo allora un radicale cambiamento delle funzioni enzimatiche e proteiche, con informazioni distorte che arrivano al DNA, che quindi potrebbe “adeguare” la sua funzione ai cambiamenti che avvengono nel citoplasma.
Inoltre l’incremento di sodio dentro la cellula non solo trasferisce calcio dai depositi mitocondriali, ma soprattutto porta quantità sempre più elevate di glucosio nel citoplasma. In questo modo si modificano i processi di respirazione cellulare con un aumento importante della glicolisi, che può spingere la cellula ad una duplicazione incontrollata proprio per l’assenza di controllo metabolico. Siamo convinti che questa catena di eventi costituisca il meccanismo di innesco biochimico della degenerazione cellulare.
Metodi e risultati
L’ascorbato ed il ribosato di potassio si ottengono estemporaneamente a freddo miscelando il contenuto di una bustina di acido ascorbico e ribosio (rispettivamente 150 mg e 3 mg) e quello di una bustina di bicarbonato di potassio KHCO3 (300 mg) in 20 cc di acqua. I componenti devono essere in forma cristallizzata purissima (livello di purezza non inferiore al 97%) e, essendo instabili se mescolati a secco, devono essere mantenuti separati.
Il composto, in presenza di una patologia neoplastica, viene somministrato in generale tre volte al giorno:
- la mattina a digiuno (15-20 minuti prima di colazione);
- 45 minuti prima di pranzo e cena.
I dati presentati si riferiscono ad un campione di 1.200 pazienti con differenti tipi di tumore in fase avanzata e, per la maggior parte, con precedenti interventi chirurgici e pregressi trattamenti radio e polichemioterap ici, trattati con ascorbato di potassio (il ribosio è stato introdotto in questi ultimi anni) e seguiti dai propri medici curanti per tutto il tempo di trattamento.
Discussione
Questi dati, anche se solo orientativi sulle potenzialità del composto, sono da mettere in evidenza con la citata azione del potassio a livello intracellulare grazie all’azione di carrier dell’acido ascorbico e l’effetto catalizzatore del ribosio. Infatti, la presenza sempre più rilevante di potassio nelle cellule tumorali ha l’effetto di indurre la fuoriuscita di sodio (e di glucosio, per il loro stretto legame) dal citoplasma, producendo:
- una nuova modificazione di pH intracellulare;
- una rapida riduzione delle riserve nutritive, riducendo la glicolisi e reintroducendo i sistemi di controllo sulla mitosi cellulare; in tal modo è possibile tentare di inibire la duplicazione incontrollata.
Non deve sorprendere più di tanto che un composto così semplice possa mostrare effetti così importanti, perché si tratta di elementi fisiologici fondamentali per il corretto funzionamento dei sistemi biologici. È importante sottolineare che l’ascorbato ed il ribosato di potassio ci permettono di operare su diversi livelli:
- in prevenzione, mantenendo le corrette concentrazioni degli elettroliti e regolando il metabolismo cellulare;
- in presenza di rischio degenerativo, offrendo alla cellula una possibile azione di protezione e correggendo il bilancio elettrolitico;
- in presenza di patologia degenerativa per tentare di inibire i processi metabolici alterati e la duplicazione incontrollata.
In conclusione questi dati, a nostro modo di vedere, orientano a ritenere che la degenerazione cellulare sia innescata da processi di “anomalia citoplasmatica” e non da un danno diretto sul DNA, e che un corretto studio di base sui meccanismi che producono il cancro non possa prescindere dalla valutazione dei processi di comunicazione ed informazione cellulare sia a breve che a lunga distanza, superando il Dogma Centrale e guarda ndo al meraviglioso processo della vita integrando quanto più possib ile competenze diverse.
Guido Paoli si è laureato in Fisica nel 1987, presso l’Università degli Studi di Firenze, con una tesi in campo medico-nucleare relativa ad una tomografia per emissione di fotoni in cascata. Ha successivamente conseguito (1993) il titolo di Dottore di Ricerca in Fisiopatologia del dolore e si è occupato, durante la sua attività presso l’Ospedale di Careggi a Firenze, di analisi dei sistemi sensoriali nel gruppo di ricerca coordinato dalla Prof.ssa M.R. Voegelin. È membro della Società Italiana di Fisica. Dalla metà degli anni ’90 ha iniziato una collaborazione con il Dott. Gianfrancesco Valsé Pantellini relativamente agli studi sul meccanismo d’azione dell’ascorbato di potassio nelle patologie degenerative. Dal 1999 è Responsabile Scientifico della Fondazione Valsé Pantellini e dal 2004 ne è anche Vice-Pres idente.
E’ possibile contattare l’autore via e-mail: guido.paoli@pantellini.org.
Bibliografia
1 – Valsé Pantellini G (1970) “Breve cenno sulla genesi dei tumori e sopra una eventuale terapia dei medesimi con sali di potassio e in particolare con ascorbato di potassio”. Rivista di Patologia e Clinica, XXV (5), pp.219-225
2 – Valsé Pantellini G (1974) “Legami idrogeno (H) e salificazione degli stessi da parte del potassio (K) nella strutturazione della materia vivente”. Rivista di Patologia e Clinica. XXIX (4), pp.193-198
3 – Preparata G (1995): QED Coherence in Matter – World Scientific, Singapore
4 – Spaggiari PG, Tribbia C (2005): Medicina Quantistica. 2° Ed. Tecniche Nuove, Milano
5 – Popp FA (1985): Nuovi orizzonti in medicina. La teoria dei biofotoni. Nuova Ipsa Ed., Palermo
6 – Bellavite P (1988): Biodinamica. Tecniche Nuove, Milano
7- Valsé Pantellini G (1997): Il cofattore K+. Cinquant’anni di ricerca e terapia contro i tumori. Andromeda Ed. Fuoricollana n.15, Bologna
8 – Valsé Pantellini G. Paoli G (1999) “Meccanismo d’azione dell’ascorbato di potassio nei sistemi biologici”. LXXXV Congresso Nazionale della Società Italiana di Fisica, Pavia, p.191
9 – Croci S, Ortalli I, Pedrazzi G, Paoli G, Monetti D (2000) “Azione protettiva dell’ascorbato di potassio sull’ossidazione dell’emoglobina in globuli rossi umani”. LXXXVI Congresso Nazionale della Società Italiana di Fisica, Palermo, p.181
10 – Croci S, Pedrazzi G, Paoli G, Monetti D, Bronzetti G, Ortalli I (2001) “Potassium ascorbate as protective agent in oxidation of red cells. Abstract of the International Conference on Antioxidants in Cancer Prevention and Therapy”, Athens (Greece) :1571-1572
11 – Croci S, Pedrazzi G! , Paoli G, Monetti D, Ortalli I (2002): Potassium ascorbate as protective agent in the oxidation of the red blood cells. Hyperfine Interactions (C). Proceedings of the International Conference on the Applications of the Mössbauer effect (ICAME 2001). M.F. Thomas, J.M. Williams, T.C. Gibb Ed.(s), Kluwer Academic Publishers, pp.241-244
12 – Paoli G (2003) The biomagnetic nature of cancer and the role of potassium ascorbate and ribose against cellular degeneration. J. New Energy, 7(3), pp. 114-119
13 – Pizzichini M, Micheli V, Marcolongo R, Marinello E (1978): Metabolismo del ribosio nell’uomo. Boll. Soc. It. Biol. Sper. (LIV), pp. 420-424
14 – Moran LA, Scrimgeour KG, Horton HR, Raymond SO, Rawn JD (1996): Biochimica. 2nd Ed., McGraw-Hill Italia, Milano
15 – Hughes F, Bortner C, Purdy G, Cidlowski J (1997): Intracellular K+ suppresses the activation of apoptosis in lymphocyte s. J. Biol Chem., (272), pp.30567-30576
16 – Hughes FM Jr, Cidlowski JA. (1999) Potassium is a critical regulator of apoptotic enzymes in vitro and in vivo. Adv. Enzyme Regul., 39, pp.157-171
17 – Montague J, Bortner C, Hughes F, Cidlowski J (1999) A necessary role for reduced intracellular potassium during the DNA degradation phase of apoptosis. Steroids, 64, pp.563-569
18 – Lehninger AL (1979): Biochimica. Zanichelli, Bologna
19 – Von Euler H, Skarzynski B (1945) La biochimica dei tumori. Einaudi. Torino. Cap.II, pp. 78-83
